
全部
▼
搜索
熱搜:
位置:中冶有色 >
> Ti-Zr-Cu合金的抗菌性能和體外生物相容性
 278
編輯:中冶有色技術(shù)網(wǎng)
來源:于佳瑩,楊希祥,戰(zhàn)德松,楊柯,任玲,王敬人,徐嘉蔚
278
編輯:中冶有色技術(shù)網(wǎng)
來源:于佳瑩,楊希祥,戰(zhàn)德松,楊柯,任玲,王敬人,徐嘉蔚
| Alloy | Ti | Zr | Cu | Fe | C | O | N | H |
|---|---|---|---|---|---|---|---|---|
| Ti-Zr | Bal. | 15.20 | 0.01 | 0.04 | 0.05 | 0.07 | 0.004 | 0.002 |
| Ti-Zr-Cu | Bal. | 14.50 | 3.00 | 0.04 | 0.04 | 0.08 | 0.007 | 0.002 |
| Level | RGR/% | Evaluation results |
|---|---|---|
| 0 | ≥100 | Qualified |
| 1 | 75~99 | Qualified |
| 2 | 50~74 | Overview |
| 3 | 25~49 | Failed |
| 4 | 0~24 | Failed |
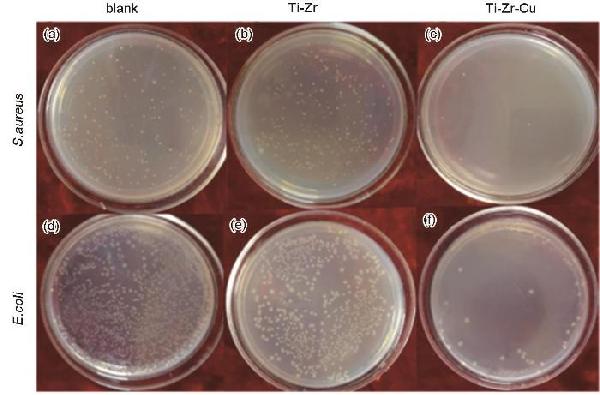
| Group | S. aureus | E. coli | ||
|---|---|---|---|---|
| Colony mean | Sterilizing rate | Colony mean | Sterilizing rate | |
| Ti-Zr-Cu | 5±4.99 | (98.28±1.58)% | 21±4.69 | (97.67±0.49)% |
| Ti-Zr | 294±16.44 | — | 900±12.96 | — |
| blank | 325±18.52 | — | 1087±43.60 | — |
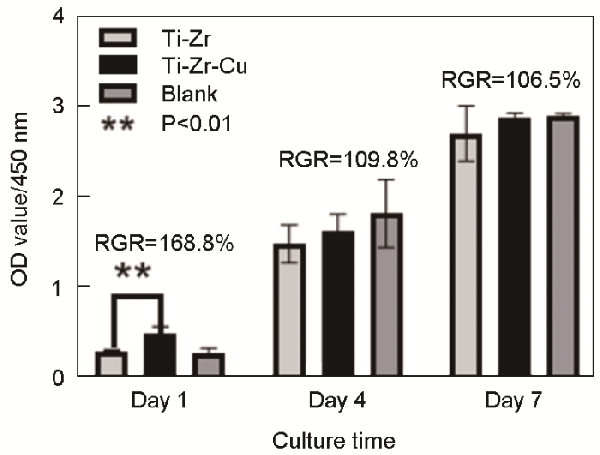
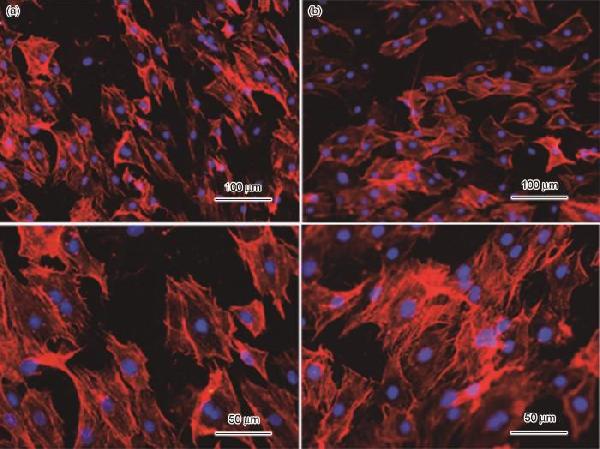
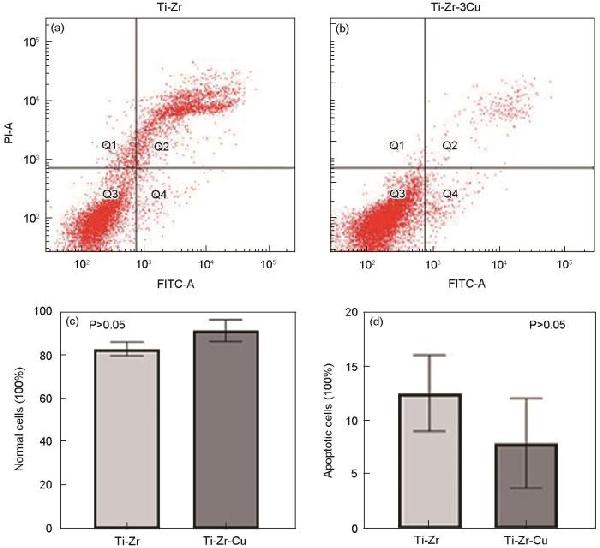

 分享 0
分享 0
 舉報 0
舉報 0
 收藏 0
收藏 0
 反對 0
反對 0
 點(diǎn)贊 0
點(diǎn)贊 0

 中冶有色技術(shù)平臺
中冶有色技術(shù)平臺 2025年03月28日 ~ 30日
2025年03月28日 ~ 30日  2025年03月28日 ~ 30日
2025年03月28日 ~ 30日  2025年03月29日 ~ 31日
2025年03月29日 ~ 31日  2025年04月11日 ~ 13日
2025年04月11日 ~ 13日  2025年04月27日 ~ 29日
2025年04月27日 ~ 29日 
